Research
膠原病の病態解明と新規治療薬の開発
ベーチェット病の病態解明研究
【研究の背景と仮説】
1. ベーチェット病の病態と治療
ベーチェット病は、主に口腔粘膜のアフタ様潰瘍、外陰部潰瘍、皮膚の結節性紅斑、眼のぶどう膜炎といった症状が繰り返す炎症性疾患で、ほかにも、関節や精巣、消化管、神経、血管などに症状を認めることもある、厚生労働省が認定する指定難病の一つです。トルコのHulsi Behçet教授が初めて報告したことからベーチェット病(ベーチェット症候群)と呼ばれ、トルコや地中海沿岸諸国から極東アジアにかけて患者が多く、その分布からシルクロード病とも言われています。発症原因は分かっていませんが、病気になりやすい遺伝的素因に加えて、細菌や喫煙、食習慣などの環境要因が合わさって病気が発症すると考えられています。ベーチェット病の病変部では、白血球の一つである好中球の異常活性化と血管炎が認められ、自然免疫系と獲得免疫系の異常の両方が重なり合ってベーチェット病の病態を形成しているものと考えられていますが、その詳細なメカニズムは未だ分かっていません。
治療は、好中球の遊走を抑えるコルヒチンが第一選択薬で、重症度や病変部位に応じてステロイドや免疫抑制剤による治療を行うこともあり、重要臓器病変や難治例にはTNF-a阻害抗体の注射薬(レミケードやヒュミラ)を使用することもあります。また、難治性口内炎に対してPDE4阻害薬(オテズラ)を投与することもあります。TNF-α阻害薬が使えるようになってぶどう膜炎により失明してしまう患者さんの数は減少しましたが、未だに難治な症例が存在し、病態に即した分子標的治療薬の開発が求められています。
参考:
2. ミトコンドリアDNA (mtDNA) と炎症
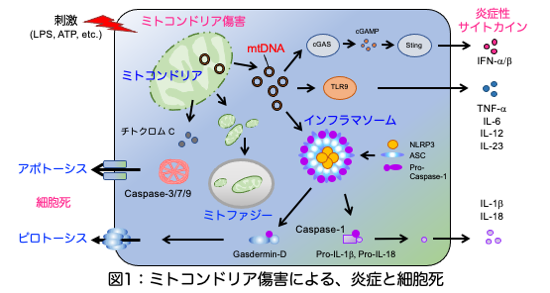
ミトコンドリアは細胞内小器官(オルガネラ)の一つで、ミトコンドリアには他のオルガネラには見られない、核とは独立したゲノム(ミトコンドリアDNA)や二重膜構造があり、エネルギー産生能があり、細胞外に漏れ出ると強い炎症誘導活性を有することなどから、ある好気性細菌が真核細胞の前身となる細胞に寄生し、その後の共生進化したものと考えられています(細胞内共生説)。細胞内におけるミトコンドリアの役割は、呼吸によるエネルギー(アデノシン三リン酸;ATP)の産生、熱産生、細胞内カルシウムイオン濃度の調節、脂質の酸化など、エネルギー代謝の中心的役割を担っていますが、近年、アポトーシスの誘導、炎症性シグナル分子の活性化プラットフォーム、活性酸素種(ROS)の産生、インフラマソームの活性化など、免疫応答においても重要な機能を有していることが分かってきました。
ミトコンドリアDNA(mtDNA)は、環状構造をしていて、ミトコンドリアの機能を司る分子のDNAやトランスファーRNAなどの遺伝情報がコードされています。mtDNAは細胞傷害時の宿主由来の炎症性物質(DAMPs)としても知られ、ミトコンドリアから細胞質内に漏れ出ると、自然免疫受容体であるToll様受容体(TLR9)や、二本鎖DNAのセンサーであるcGAS、インフラマソームの構成分子であるNLRP3などに認識されて、様々なサイトカインの産生を誘導します(図1)。
ヒト疾患においてmtDNAはDAMPsとして、外傷後の急性呼吸促迫症候群(ARDS)、心不全、全身性エリテマトーデス(SLE)などの増悪に寄与することが報告されていますが、どのような機序で、細胞内や細胞外に漏出するのか、また、SLE以外の免疫系疾患における意義については分かっていませんでした。
参考:
Mitochondrial DNA in innate immune responses and inflammatory pathology. A. Phillip West & Gerald S. Shadel. Nat Rev Immunol. 17, 363–375 (2017)
当研究グループでは、「ベーチェット病の病態にmtDNAが関与しているのではないか」、との仮説を立て、それを実証して有効な治療法の開発に繋げる研究に取り組んでいます。
【成果】
1. ベーチェット病における血清mtDNAの増加とそのメカニズム
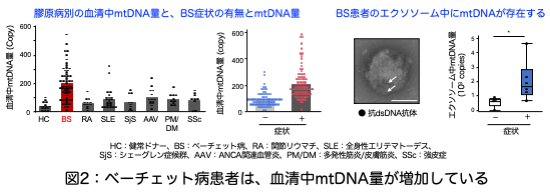
高松らは、大阪大学医学部呼吸器・免疫内科にて、ベーチェット病患者さんの血清を収集し、血清中mtDNA量をPCR法にて定量し、他の膠原病患者の血清中mtDNA量と比較しました。すると、ベーチェット病患者血清で著しく増加していることを見出しました。また、血清mtDNA量はベーチェット病の症状がある患者さんに高く、同じ患者さんでも、やはり症状が出ている時に高いことが分かりました。さらに、血清中のmtDNAはDNA分解酵素(DNase)にて分解されず、膜に包まれて存在していることが分かりました。そこで、どのような膜にmtDNAが存在しているのか検討すると、エクソソームと呼ばれる直径100nm程の非常に小さい細胞外膜小胞中に存在していることが分かりました(図2)。
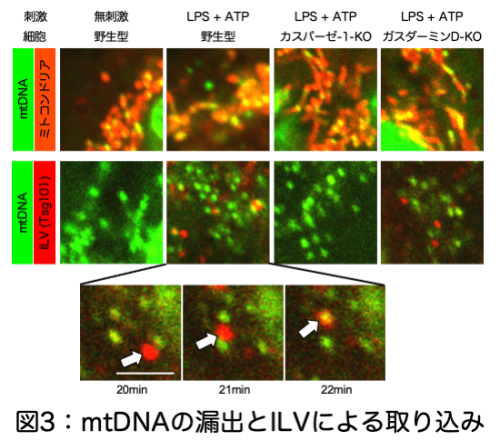
そこで、mtDNAがミトコンドリアから細胞質に漏出し、それがエクソソームによって細胞外に放出される機序について調べてみると、細胞に刺激が加わると、カスパーゼー1の活性化によりインフラマソームの活性化とそれに引き続くピロトーシスという細胞死が誘導されますが、その際にGasdermin-Dという分子によってミトコンドリアの膜に穴が開けられてmtDNAがミトコンドリアから細胞質に漏出すること、また、カスパーゼ-1により細胞内膜小胞(MVB: multi-vesicular body)の中にさらに微小の膜小胞(ILV: intraluminal vesicle)が形成され、その過程で細胞質内のmtDNAがILVに取り込まれることが分かりました。その後MVBが細胞膜と融合し、MVB内のILVが細胞外に放出され、それらがエクソソームとして血流に乗って全身に運ばれることが分かりました。実際にベーチェット病患者さんの単球系細胞では、カスパーゼ-1の活性が高まっていることも確認されました(図3)。
2. ベーチェット病患者血清由来のmtDNAを内包したエクソソームによる炎症誘導
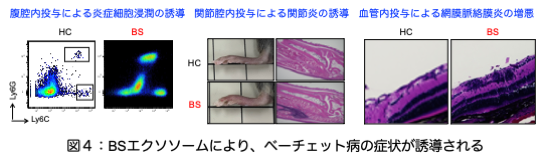
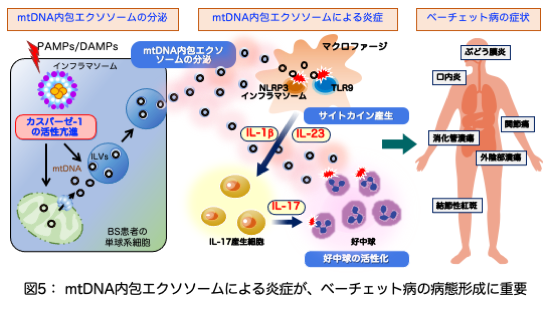
エクソソームはエンドサイトーシスと呼ばれる貪食により、放出細胞に由来する様々な分子やDNA/RNAを別の細胞に伝える役割をしていることが知られています。そこで、mtDNAを内包したエクソソームがベーチェット病に特徴的な炎症を誘導するかについてマウスを使って実験しました。先ず、ヒトの末梢血由来の単核球(PBMCs)にベーチェット病患者から単離したエクソソームを振りかけると、TNF-α、IL-1β、IL-23といった炎症性サイトカインが産生されました。さらにマウスの腹腔に投与すると、激しい好中球や炎症性単球の浸潤を認め、マウスの関節腔に投与すると、炎症性細胞の浸潤により関節が腫脹しました。また、自己免疫性ぶどう膜炎のモデルマウスに投与すると、網膜ぶどう膜炎が増悪し、ベーチェット病患者エクソソームの強い炎症誘導活性によりベーチェット病に特徴的な炎症を惹起することが分かりました(図4)。
そして、ベーチェット病由来エクソソームによる炎症は、MLRP3とTLR9というmtDNAの受容体を介していることが分かり、エクソソーム中のmtDNAが重要であることが分かりました。また、膜に包まれたmtDNAはmtDNA単体に比べて炎症誘導活性が非常に強いことが分かり、エクソソームに内包されることにより細胞内のmtDNAセンサーにmtDNAが効率よく認識され、強い炎症が惹起されるものと思われました。
以上から、ベーチェット病は、まだ分かっていない理由によりカスパーゼ-1が活性化しやすく、それにより、ガスダーミンDが活性化してミトコンドリア膜に穴を開けてミトコンドリア内のmtDNAが細胞質に漏出し、細胞質内のmtDNAはILVに取り込まれエクソソームとして細胞外に放出されます。mtDNAを内包したエクソソームは、マクロファージなどの細胞に取り込まれ、NLRP3、TLR9を介して炎症性サイトカイン産生を誘導します。mtDNA内包エクソソームおよびサイトカインにより、好中球の異常活性化というベーチェット病の病態が形成され、特徴的な臨床症状が生じるものと考えられました(図5)
3. mtDNA内包エクソソーム産生を標的とした治療の可能性
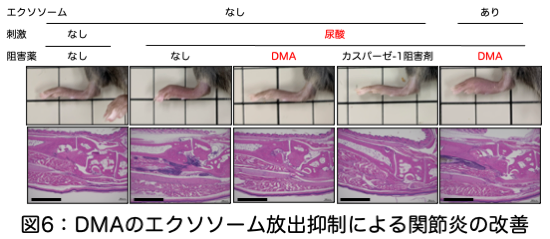
ベーチェット病は、コルヒチン、ステロイド、TNF-α阻害抗体等で治療されますが、mtDNAが細胞外に放出される過程を標的とした治療について検討しました。カスパーゼ-1阻害薬は、予想通りmtDNAの漏出や細胞外への放出、IL-1β等のサイトカイン産生を抑制しますが、カスパーゼ-1は細胞にとって必要不可欠な機能を担うため副作用も強くなることが予想されます。そこで、エクソソーム(ILV)の産生を阻害するdimethylamine(DMA)という薬剤に着目し、mtDNA内包エクソソームによる関節炎を抑制できるか検討しました。DMA投与群では関節炎がカスパーゼ-1阻害剤と同程度に抑制されることが分かりました。DMAはカスパーゼ-1阻害剤とは異なりインフラマソームによるIL-1β産生は抑制しないことから、mtDNA内包エクソソームが炎症の誘導に重要であることと、一連のエクソソームによるmtDNA内包過程がベーチェット病の新たな治療標的となることが示唆されました。今後、mtDNAを内包してエクソソームによる炎症というベーチェット病の病態に即した分子標的治療法開発への発展が期待されます(図6)。
本研究成果は、2023年 The EMBO Journalに掲載されました。
Konaka H, Kato Y, Hirano T, Tsujimoto K, Park JH, Koba T, Aoki W, Matsuzaki Y, Taki M, Koyama S, Itotagawa E, Jo T, Hirayama T, Kawai T, Ishii KJ, Ueda M, Yamaguchi S, Akira S, Morita T, Maeda Y, Nishide M, Nishida S, Shima Y, Narazaki M, Takamatsu H (*Correspondece author), and Kumanogoh A. Secretion of mitochondrial DNA via exosomes promotes inflammation in Behçet's syndrome. EMBO J. 2023 Sep 4;e112573. doi: 10.15252/embj.2022112573